私たちの研究室では、ナノ・マイクロメートルサイズの微細加工技術を医学・生物学分野に応用することを目指し、新たな計測デバイス技術の研究開発を行っています。大きく分けると、バイオサンプルを機械加工し新たな解析を可能にする「生体機械加工」、1細胞毎の刺激に対する応答を計測する「細胞刺激と応答計測」、様々な基盤技術「バイオサンプル操作」と「以前の研究」となり、以下に最近取り組んでいる研究テーマを紹介します。
生体機械加工
臓器空間分画
医学や生物学において、細胞に含まれている生体分子の種類・量を1細胞毎に解析する技術が発展しています。一方で、解析した細胞が体の中のどの場所、臓器のどの部分に由来するものか、という空間的な情報は多くの場合失われています。
我々は、臓器のどの場所にあったものか分かった状態、つまり空間情報を有した状態で細胞サイズの微小領域を回収する技術の開発に取り組んでいます。本技術が実現することで、解析した細胞の物質情報と臓器中の空間情報を紐づけることが可能となり、例えばがん微小領域の解析や、様々な臓器の空間構造と機能の関係を解明することに繋がると期待されます。
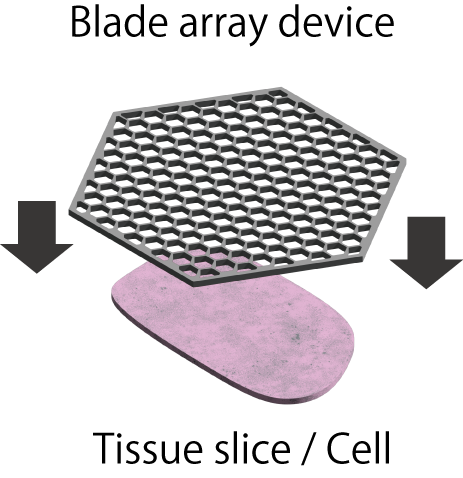

微細加工技術により微小な刃状構造体がアレイ状に構成されたブレードアレイデバイスと名付けたデバイスを開発し、空間情報を有した細胞サンプリングの実現を目指しています。本デバイスを用いて、1個の細胞を複数の微小領域に、または臓器を1細胞サイズに区画化して、物理的に一括で切断する「空間分画技術」と呼ぶ新たな細胞加工技術を開発しています。
参考文献
光駆動ナノツール
集光したレーザーの焦点では、ナノメートルからマイクロメートルの大きさの微小な物体を捕捉することができ、この現象は光ピンセットとして知られています。我々は、光ピンセットで捕捉する微小物体に様々な形状を持たせ、表面処理を施すことで高度な機能を発現させ、ナノ領域のツールとして利用することを目指しています。このような光で駆動する微小ツールを用いることで、1細胞や生体分子1個の操作・加工といった、従来のバイオ実験では扱うことの難しい領域にアプローチします。
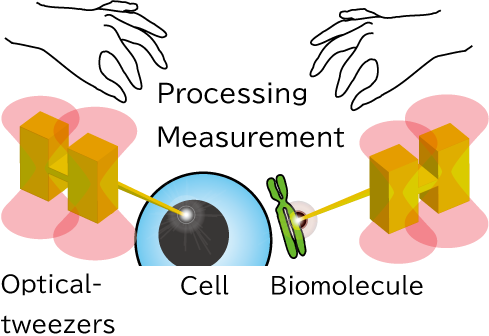

我々が開発する光駆動ツールは、半導体微細加工技術で大量一括作製することができ、水溶液中に百万個単位で得ることができます。ツールは様々な形状に設計できるだけでなく、表面に金属膜を形成することや表面修飾により酵素や抗体を固定化することで機能化させることができます。
参考文献
- M. Harada, H. Takao, F. Shimokawa, K. Terao*: “Development of optically driven nanoneedles using SU-8 nanofabrication”, Electronics and Communications in Japan, 105(1), e12327 (2022)
- K. Terao*, C. Masuda, R. Inukai, M. Gel, H. Oana, M. Washizu, T. Suzuki, H. Takao, F. Shimokawa, F. Oohira: “Characterization of optically-driven microstructures for manipulating single DNA molecules under a fluorescence microscope”, IET Nanobiotechnology, 10(3), 124-128(2016)
模擬臓器形成に向けた1細胞分解能の細胞組み立て
創薬や再生医療の分野で、疑似的な臓器構造を生体外で形成し、動物実験の代替にすることや、通常の培養細胞よりも生体内の状態に近いサンプルとして臨床試験の前段階で利用することが期待されています。自己組織的に細胞塊を形成する手法やバイオプリンティングによる手法が提案されていますが、1細胞レベルで種類や位置を調節することは困難です。その課題を解決するため、我々は1個1個の細胞を思い通りに組み立て、様々な細胞組織構造を形成することを目指しています。
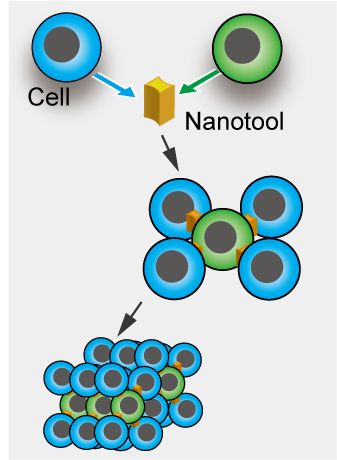
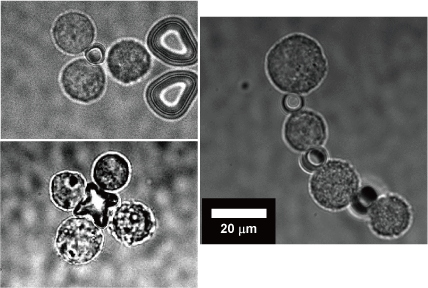
我々は上記の光駆動ナノツールを細胞組み立てに応用しています。半導体微細加工技術で作製した微小構造体の表面に、細胞に接着する分子を修飾することで細胞同士をつなぐ接着剤としての機能を持たせました。本ツールと細胞をレーザー光で操作することで細胞を短時間でブロックのように組み立てることができます。
参考文献
- S. Mori, T. Ito, H. Takao, F. Shimokawa, K. Terao*: “Optically-driven microtools with an antibody-immobilized surface for on-site cell assembly”, IET Nanobiotechnology, 1-7 (2023)
生体分子の1分子機械加工
生体分子は通常、水溶液中で分子集団として、処理されます。そのため、個々の分子の情報は失われ平均化された情報が得られることになります。また、代表的な生体分子であるDNA分子はひも状の高分子ですが、溶液の流れによって容易に断片化するため、分子を無傷の状態でそのまま扱うことは困難です。したがって、広く普及している生体分子解析技術の多くは、分子集団を対象とし、DNA分子については、断片化したものを増幅することで解析を行います。その過程で分子個々の違いや、空間構造や機能が失われます。そこで、我々は、分子を集団ではなく1分子毎に操作し、加工し、解析する技術の実現に向けて技術開発を行っています。
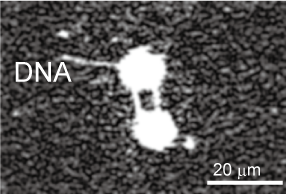
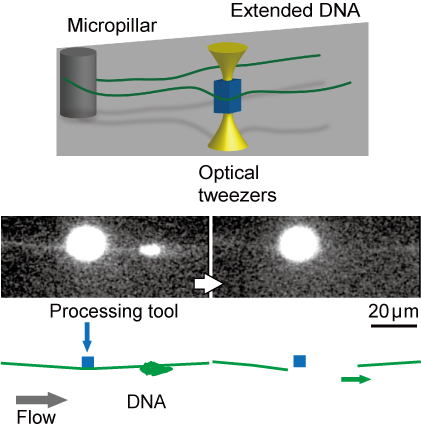
これまでに断片化しやすい長大なDNA分子を対象に1分子の操作と加工の基礎的な技術を実現してきました。DNA1分子を用いた様々な観察実験を顕微鏡下で行うため、レーザーや電気浸透流を用いてDNA分子の形態を任意に操作する技術や、空間情報を有したDNAの特定部位の回収を可能にするため、標的DNA1分子を狙った位置で切断し回収する技術を開発しました。
参考文献
- A. Masuda, H. Takao, F. Shimokawa, K. Terao*: “On-site processing of single chromosomal DNA molecules using optically driven microtools on a microfluidic workbench”, Scientific Reports, 11, 7961 1-9 (2021)
- R. Inukai, H. Takao, F. Shimokawa, K. Terao*: “Capture and elongation of single chromosomal DNA molecules using optically-driven microchopsticks”, Biomicrofluidics, 14, 044114 (2020)
- K. Terao*, M. Washizu, H. Oana: “On-Site Manipulation of Single Chromosomal DNA Molecules by using Optically Driven Microstructures”, Lab on a Chip, 8(8), 1280-4 (2008)
細胞刺激と応答計測
受容体解析に向けた1細胞局所薬剤刺激
創薬あるいは細胞生物学において、細胞が薬剤に対してどのように応答するのかという細胞応答について計測することは基本的かつ重要な実験です。薬剤の多くは細胞表面に存在している受容体をターゲットにしています。受容体は薬剤分子と相互作用し、細胞の応答を誘起/抑制します。薬剤と相互作用する受容体数と細胞の応答量の関係は、細胞種や細胞の状態毎に異なっていると考えられますが、十分に分かっていません。本研究では、この点に着目し、マイクロ流体デバイスによって薬剤ー受容体の相互作用と細胞応答の関係を1細胞毎に解析する技術の開発に取り組んでいます。本技術によって、細胞毎の応答性を明らかにすることで創薬や個別化医療に貢献することを目指します。
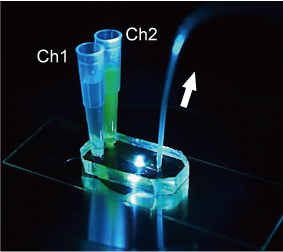
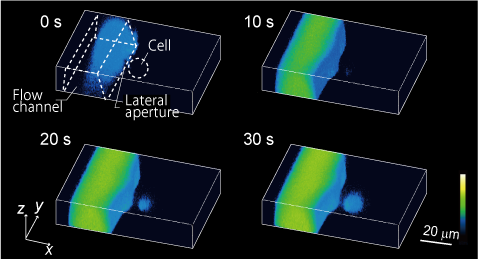
我々は、マイクロ流体デバイスを開発し、細胞表面の極一部の規定された面積領域に薬剤を与えることで、局所的な刺激に対する細胞応答やシグナルの局在・伝搬を計測する新しい実験技術の開発を進めています。これらの取り組みを通して、現在は受容体と細胞応答の関係を細胞毎に定量的に解析する手法の開発を行っています。
参考文献
- K. Terao*, M. Gel, A. Okonogi, A. Fuke, T. Okitsu, T. Tada, T. Suzuki, S. Nagamatsu, M. Washizu, H. Kotera: “Subcellular Glucose Exposure Biases the Spatial Distribution of Insulin Granules in Single Pancreatic Beta Cells”, Scientific Reports, 4, 4123 1-6 (2014)
- K. Terao*, A. Okonogi, A. Fuke, T. Okitsu, T. Suzuki, M. Washizu, H. Kotera: “Localized substance delivery to single cell and 4D imaging of its uptake using a flow channel with a lateral aperture”, Microfluidics and Nanofluidics, 12(1), 423-429 (2012)
分化誘導制御へ向けたiPS細胞胚様体への薬剤刺激
iPS細胞から目的の細胞に変える操作を分化誘導といいます。薬剤等を用いて分化誘導を行いますが、未分化のままの細胞や目的外の細胞が生じ、同じ分化誘導操作を行っても不均一な細胞集団が得られます。これらの分化誘導の不均一性は腫瘍形成のリスクや細胞の品質保証の観点からiPS細胞実用化の障害の一つとなります。


我々は生体内と近い環境を再現できる胚様体(Embryotic Body)をマイクロデバイスで形成し、胚様体周囲の微小環境を調節することで、分化誘導を制御することを試みています。広く普及しているディッシュやウェルプレートの規格に適合する新たなマイクロデバイスを開発することで、様々な溶液操作や解析装置との互換性を確保しています。
参考文献
- N. Kusunoki, S. Konagaya, M. Nishida, S. Sato, H. Takao, F. Shimokawa, K. Terao*: “Microfluidic device for differentiation induction of iPS cells with local chemical stimulation”, Electronics and Communications in Japan, 105(3), e12393 (2023)
がん細胞の変形応答を可視化する生体外血管狭窄モデル
がんによる死の多くは転移を伴い、転移に至る過程でがん細胞が血液中を循環します。この過程を生体内で観察することは血中におけるがん細胞の希少さと高速な移動によって極めて難しいとされています。そのため、これまで生体外にがん細胞の血液循環過程を再現する技術が提案されてきました。特に転移に重大な影響を与えると考えられる毛細血管での挙動が注目されており、がん細胞がどのように微小な狭窄構造を変形して通過するか、通過した細胞がどのように回復し、性質を変化させるのかということが未解明の課題となっています。
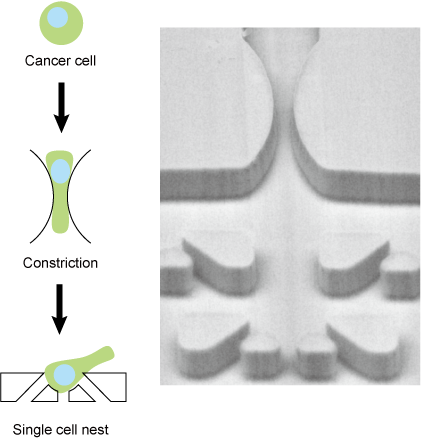
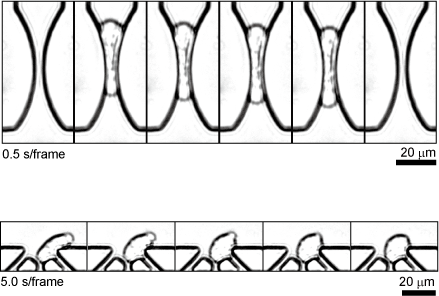
我々が開発したマイクロ流体デバイスは、血管の微小狭窄構造を再現するだけでなく、狭窄構造を通過した直後の変形したがん細胞を捕捉し顕微鏡観察するためのマイクロネスト構造を有します。それにより、がん細胞が狭窄構造を変形して通過し、通過後形状を回復していく一連の過程を一細胞毎に連続的に追跡することが可能です。これによりがん細胞の血液循環中に起きる現象の解析や将来的にはがん細胞の診断につながることが期待されます。
参考文献
- E. Gasser*, E. Su, K. Vaidziulyte, N. Abbade, H. Cognart, J.B. Manneville, J.L. Viovy, M. Piel, J.Y. Pierga, K. Terao*, C. Villard*: “Deformation under flow and morphological recovery of cancer cells”
Lab on a Chip, 24, 3930-3944 (2024)
バイオサンプル操作技術
疾患の腎微小環境を再現するマイクロ流体デバイス
我々は、生体内の腎臓の微小環境を生体外に再現するマイクロ流体デバイスの開発に取り組んでいます。特に、敗血症性急性腎障害(AKI)の状況を生体外に再現し、疾患のメカニズムや治療法の開発に役立てることを目指します。AKIでは尿細管細胞のバリア機能が失われ、尿が組織にリークし、乏尿・無尿、炎症を引き起こすと言われており、重大な疾患ですが、生体内では観察は難しいことが課題です。

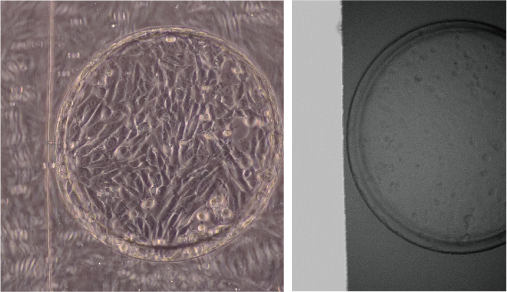
そこで、我々は生体外で尿の通り道をマイクロ流路で再現し、敗血症性ショックを受けたときの尿細管細胞の変化を1細胞レベルで観察することができ、さらに尿のリークや他種細胞との相互作用が計測できるデバイスの開発に取り組んでいます。
DNA1分子動態解析用「分子輪投げ」
DNA分子の構造変化は細胞における機能発現や抑制を通して生命機能の維持や疾患に重要な役割を果たしています。そのために、DNA1分子の動態を計測する手法がこれまで多く開発されてきました。しかし、多くは末端を持つ直鎖上のDNA分子を対象にしたものに限られています。それに対し、我々は、環状DNA分子に着目しました。環状DNAは末端を持たないため分子のねじれや弛緩といった特徴的な変化の観察に適しています。
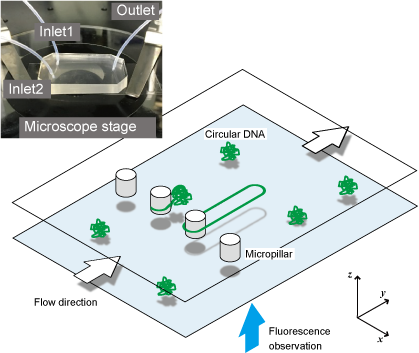

広く1分子操作に用いられる末端化学修飾は環状DNAには利用できません。そのため、物理的に環状DNA分子を捕捉し、顕微鏡下で可視化する技術を開発しました。微細加工技術で作製したマイクロピラー構造に「輪投げ」のように環状DNAをひっかけて流れによって展開することで環状DNAの動態を1分子で観察することができます。
参考文献
- D. Dohi, K. Hirano*, K. Terao*: “Molecular ring toss of circular BAC DNA using micropillar array for single molecule studies”, Biomicrofluidics, 14, 014115 (2020)
2Dマイクロノズルアレイ
微小な開口から溶液を吐出する機構であるマイクロノズルは、微細なファイバーを作製することや基板表面の限られた領域に化学処理を行うことができます。そのため、バイオプリンティングやバイオパターニングに利用されています。このマイクロノズルを2次元的に高密度にアレイ状に集積することができれば、開口から多種の溶液の複雑な流れを形成することができ、高度な模擬臓器形成や高集積バイオセンサの実現に繋がることが期待されます。

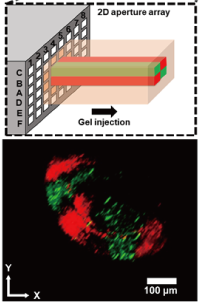
我々は、これまでにステンレス微細加工や樹脂成型によって高密度なマイクロノズルアレイを開発してきました。本デバイスを用いて、断面パターンを調節可能なゲルファイバーの形成や基板表面への多種抗体の同時微細パターニングを実施しました。
参考文献
- K. Takahashi, H. Takao, F. Shimokawa, K. Terao*: “On-demand formation of heterogeneous gel fibers using two-dimensional micronozzle array”, Microfluidics and Nanofluidics, 26, 15 (2022)
- K. Takahashi, S. Kamiya, H. Takao, F. Shimokawa, K. Terao*: “Stainless Microfluidic Probe with 2D array Microapertures”, AIP Advances, 11(1), 015331 (2021)
以前の研究
微細構造による表面バイオセンサの高機能化
医療診断や薬剤探索において、低分子量、低濃度の生体分子をセンシングする需要が高まっており、例えば血中がんマーカーの検出によるがんの早期診断の実現が期待されています。我々は医療・食品・基礎研究に応用することを目指し、非標識でセンシング可能という利点を持つ、表面バイオセンサに着目し、MEMS技術を用いた高感度化と高機能化に取り組んできました。

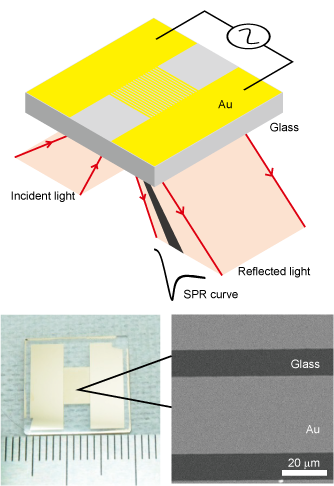
表面プラズモン共鳴(SPR)センサチップにマイクロスリット構造を作製することで、サイズ弁別能を付加したフィルタSPRセンサチップを開発しました。ナノ粒子の凝集・脱凝集測定が可能であり、また、全血から100秒以内で血中タンパク質を検出できます。
他にも、バイオセンサ表面にメッキ処理によりナノメートルサイズの微細な金の凹凸構造(金黒)を形成した金黒バイオセンサチップや、交流電場を印加可能な櫛場電極型センサチップを開発しました。水晶振動子マイクロバランス法(QCM法)と表面プラズモン共鳴法(SPR法)において、数倍の検出量の向上が得られました。
参考文献
- K. Terao*, S. Kondo: “AC-Electroosmosis-Assisted Surface Plasmon Resonance Sensing for Enhancing Protein Signals with a Simple Kretschmann Configuration”, Sensors, 22(3), 854 1-9 (2022)
- K. Terao*, S. Hiramatsu, T. Suzuki, H. Takao, F. Shimokawa, F. Oohira: “Fast protein detection from raw blood by size-exclusion SPR sensing”, Analytical Methods, 7, 6483-6488 (2015)
- N. Nagase, K. Terao*, N. Miyanishi, N. Tamai, N. Uchiyama, T. Suzuki, H. Takao, F. Shimokawa, F. Oohira: “Signal Enhancement of Protein Binding by Electrodeposited Gold Nanostructures for Application in Kretschmann-Type SPR Sensor”, Analyst, 137(21), 5034-5040 (2012)
- K. Terao*, K. Shimizu, N. Miyanishi, S. Shimamoto, T. Suzuki, H. Takao, F. Oohira: “Size-Exclusion SPR Sensor Chip: Application to Detection of Aggregation and Disaggregation of Biological Particles”, Analyst, 137(9), 2192-2198 (2012)
細胞間相互作用解析に向けた1細胞操作
単独で存在するときと集団で存在するときで細胞の機能は異なり、細胞間の相互作用が機能発現に重要や役割を果たしています。生体外でマイクロデバイス等により、細胞の種類や配置を調節することで、生じる細胞間相互作用と細胞機能について調べる技術が開発されています。我々は、1細胞レベルで配置を調節可能なマイクロ流体デバイスを開発してきました。

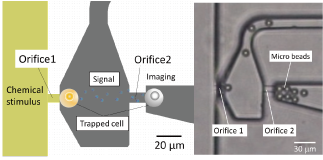
従来の培養ディッシュでは細胞の位置がランダムなため、相互作用を制御された環境下で計測することは困難でした。それに対し、電場で駆動される流れを利用して2種類の細胞を隣同士に並べ異種細胞間の接触性相互作用を解析するデバイスを開発しました。また、2個の細胞を規定した距離だけ離して配置し、一方の細胞にのみ薬剤刺激を与えることで、非接触性(液性)相互作用を解析するデバイスも開発しました。
参考文献
- Y. Tao, K. Fukuda, H. Takao, F. Shimokawa, and K. Terao*: “Development of microfluidic device for imaging paracrine communication”, IEEJ Transactions on Sensors and Micromachines, 137(5), 128-133(2017)
- K. Terao*, Y. Kitazawa, R. Yokokawa, A. Okonogi, H. Kotera: “Open-Access and Multi-Directional Electroosmotic Flow Chip for Positioning Heterotypic Cells”, Lab on a Chip, 11(8), 1507-1512(2011)
